Una empresa nacida en un garaje ahora domina el mundo de los dispositivos médicos gracias a un crecimiento explosivo basado en tecnología que puede salvar vidas. Con el éxito se multiplicaron las acusaciones de efectos dañinos de sus productos. Acumula ncumplimientos a las normas sanitarias y acusaciones de irregularidades en todo el mundo.
En el otoño de 2008, el gigante de los productos sanitarios Medtronic estaba en caída libre. Sus beneficios se hundían. La compañía se enfrentaba a cientos de demandas judiciales porque uno de sus aparatos cardíacos estaba provocando shocks en algunos pacientes, sin causa aparente. En otros casos, el dispositivo simplemente no funcionaba.
Las autoridades estadounidenses estaban investigando a Medtronic por acusaciones de soborno a médicos europeos para que utilizaran sus dispositivos. Tan sólo unos meses antes, la empresa había accedido a abonar 75 millones de dólares a la sanidad pública de Estados Unidos que acusaba a una de sus subsidiarias de defraudar al sistema de salud pública.
La noche del 12 de octubre de 2008, el responsable de principios éticos de Medtronic envió tres carpetas de documentos confidenciales a los inspectores del Departamento de Salud y Servicios Sociales de Estados Unidos en Washington DC. Los archivos, remitidos al gobierno como parte de los acuerdos alcanzados por ambas partes, incluían una copia del código de conducta de Medtronic. Constaba de diez páginas. En otras cuestiones, el código se comprometía a “no pagar sobornos, cometer cohecho o realizar cualquier otro desembolso que fuera ilegal”.
Entre esos documentos estaba la copia de una carta firmada por el director ejecutivo de Medtronic, William Hawkins, remitida sus empleados. “No podemos permitirnos hacer algo que ponga en duda nuestro compromiso con la integridad. Ni la gestión contable, ni nuestros instintos competitivos, ni siquiera la orden de un superior lo justificaría”, escribió Hawkins.
A lo largo de la última década las cosas cambiaron. Medtronic ha saltado al primer puesto del escalafón mundial de la industria de los dispositivos sanitarios. Ha duplicado sus ingresos anuales hasta alcanzar los 30.000 millones de dólares en 2017. Ha lanzado al mercado cientos de productos y ha abierto oficinas en más de 160 países.
Pero también ha violado su compromiso con la integridad a escala global, según ha descubierto el Consorcio Internacional de Periodistas de Investigación (ICIJ, por sus siglas en inglés) en una investigación de un año de duración que ha explorado la industria de los productos sanitarios y que hemos denominado “The Implant Files”.
En el transcurso de esos diez años desde que la compañía se comprometiera a velar por la ética de sus actuaciones, estados de cuatro continentes han acusado a Medtronic de promover el uso no autorizado de sus productos, estafar a autoridades de sanidad pública, fijar precios de mercado, pagar a médicos para que elaboraran estudios a su favor y violar las normas de libre competencia.
El Departamento de Justicia y la Comisión de Bolsa y Valores (SEC por su sigla en inglés) de Estados Unidos investigaron a Medtronic por supuestos esquemas de sobornos en Alemania, Francia, Grecia, Polonia, Turquía y Malasia, aunque finalmente las causas fueron archivadas tras seis años de pesquisas.
Medtronic niega cualquier tipo de irregularidad y asegura que cumple con las leyes que combaten la corrupción.

Omar Ishrak., CEO de Medtronic
La historia de esa multinacional es un modelo paradigmático para comprender cómo son las prácticas empresariales de una industria que mueve 400.000 millones de dólares anuales y que ha desarrollado productos muy sofisticados para salvar vidas, pero que no ha dudado en traspasar los límites legislativos y éticos. Los competidores de Medtronic ‒Johnson & Johnson, Abbot Laboratories, Boston Scientific y sus filiales‒ también se ha enfrentado a denuncias por fraude, sobornos y por otro tipo de ilegalidades.
Las tres firmas defienden que gestionan su negocio conforme a los más altos estándares éticos, que cumplen la ley y argumentan que tienen programas muy estrictos para prevenir que sus empleados incurran en irregularidades.
Medtronic fabrica dispositivos que ayudan a controlar la diabetes, a mitigar el dolor crónico y a aliviar los síntomas del síndrome de Parkinson. Inventó un marcapasos inalámbrico del tamaño de una píldora de vitaminas. La multinacional se adentró además en nuevos campos de la medicina, como la gestión de quirófanos, la concesión de préstamos para cuidados médicos o la monitorización de pacientes.
Sin embargo, la compañía y sus filiales también se enfrentan a imputaciones por amaño de contratos en Brasil, a investigaciones por supuestas prácticas irregulares en la comercialización de dispositivos vasculares en Estados Unidos y a acusaciones por evasión fiscal en Italia.
UNA INVESTIGACIÓN EN 36 PAÍSES
Más de 250 periodistas y analistas de datos de 59 medios de 36 países han trabajado durante un año para publicar la investigación “The Implant Files”. Entrevistamos o revisamos los comentarios de más de 50 empleados de Medtronic, hablamos con decenas de funcionarios, pacientes, médicos y expertos. Los reporteros examinaron decenas de miles de páginas de documentos judiciales, registros de empresas, informes normativos, auditorías públicas, archivos de los grupos de presión, transcripciones de llamadas de analistas, artículos científicos y otros tipos de documentación.
El director ejecutivo de Medtronic, Omar Ishrak, declinó hablar con los periodistas. En un declaración escrita, el portavoz de la multinacional, Rob Clark, indicó que la prioridad de Medtronic es la seguridad de los pacientes. Añadió que la empresa se debe a los “más altos estándares éticos en su negocio”.
La empresa no respondió preguntas sobre causas legales o acusaciones específicas de malas prácticas contenidas en este artículo, pero afirmó que muchas estaban basadas en “acusaciones infundadas de litigantes y críticos de la industria”.
“Las denuncias no son hechos fehacientes y no deberían ser interpretadas para sugerir que Medtronic vulneró nuestras obligaciones legales, éticas y regulatorias”, afirmó Clark. Agregó que en los pocos casos en que los empleados o firmas afiliadas violaron las normas, ellos fueron castigados. “Nuestra reputación es el resultado del compromiso con la seguridad del paciente, la transparencia, la rendición de cuentas y una praxis empresarial ética”, explicó el portavoz.
En febrero pasado, el director general, Omar Ishrak, dijo a los inversores que las terapias de Medtronic facilitan la vida a más 70 millones personas al año, mejorando la situación de dos personas cada segundo.
Un análisis de ICIJ de los incidentes adversos registrados en los organismos reguladores de Estados Unidos entre 2008 y 2017 revela que productos fabricados por Medtronic y sus filiales están relacionados con la muerte de 9.300 personas y causaron lesiones de mayor o menor gravedad a otras 292.000.
En 2017, uno de cada cinco incidentes médicos informados estuvo vinculado a algún dispositivo de Medtronic, más del doble que los de cualquiera otro competidor. Registros de las autoridades de Noruega, Japón y Australia también señalaron a Medtronic como uno de los fabricantes con mayor número de incidentes adversos comunicados por los pacientes en los últimos cinco años.
La Administración de Alimentación y Medicamentos de Estados Unidos, más conocida como FDA, dijo que condieran “muy seriamente” todos los reportes de problemas de seguridad. Pero también hizo ver que los reports de eventos adversos pueden tener testimonios incompletos o no verificados.
En la respuesta a ICIJ, el portavoz de Medtronic enfatizó que los sistemas de seguridad y la continua supervisión de los productos, antes y después de que actúen los organismos reguladores, garantizan que los pacientes los usen con toda seguridad. Aun así, afirmó Clark, todos los productos médicos, por muy bien diseñados que estén y por muchos exámenes que pasen, siempre comportan un riesgo.
Pasado un decenio de su compromiso ético, Medtronic ha tenido que afrontar el desembolso de 3.200 millones de dólares para resolver las reclamaciones y las querellas judiciales de 20.000 pacientes. En ese mismo periodo, la multinacional acumuló unos ingresos netos de cerca de 34.000 millones. Su valor de mercado creció hasta los 125.000 millones de dólares en 2017, cuando diez años antes era de 28.000 millones.
“El modelo de negocio de Medtronic tiene mucho éxito, incluso si daña a los pacientes”, afirma el doctor Chales Rosen, un cirujano de California especializado en columna vertebral y que cofundó la Association for Medical Ethics, un grupo activista por pacientes. Rosen ha revelado en sus estudios cómo hay consultores pagados por la industria y ha hecho públicas las relaciones económicas entre las compañías de productos sanitarios y los doctores. Los costos por retirar productos del mercado o por pagar indemnizaciones por responsabilidad civil son “relativamente menores” comparados con la cantidad de beneficios que genera la industria, según Rosen. Agrega que es “solo el precio de hacer negocio”.
DE PLURIEMPLEADOS A INFORMANTES
Medtronic surgió en un garaje de Minneapolis en 1949. La fundó Earl Brakken, un ingeniero electricista pluriempleado. Ocho años después, Bakken creó un marcapasos con pilas del tamaño de un teléfono inteligente de los de hoy. El aparato se podía adherir al pecho, lo que liberaba a los pacientes cardiacos de estar postrados en una cama.
Bakken, fallecido a los 94 años en octubre pasado, contrató a administradores y a personal de ventas para suministrar productos a un lucrativo y emergente mercado de cirujanos y cardiólogos.

Earl Bakken, fundador de Medtronic, recientemente fallecido.
En 1977, Medtronic dominaba el mercado de los marcapasos y se había diversificado en la fabricación de otros productos como respiradores artificiales, eliminadores de varices o estimuladores eléctricos para tratar la debilidad de los músculos del estómago. La compañía salió a bolsa ese mismo año y apareció en la lista Fortune 500 en 1985, una clasificación que representa al medio millar de empresas de Estados Unidos con mayores ingresos.
En su apuesta por participar en el enorme mercado de productos para tratar el dolor de espalda, Medtronic adquirió en 1999 la empresa líder de ese sector, Sofamor Dane. La compañía con sede en Memphis había desarrollado Infuse, un injerto óseo para reparar discos vertebrales debilitados. Infuse, denominado en Europa como ‘InductOs’, consta de dos partes: un polvo de origen humano que estimula el crecimiento óseo y una esponja que contiene el polvo. Infuse se usa en combinación con una caja metálica que se coloca entre las vértebras. Al final, el objetivo es que las dos vértebras se fusionen.
La FDA aprobó Infuse en 2002 para ser utilizado en la parte lumbar de la columna. Los exámenes previos habían revelado que podían darse efectos colaterales perjudiciales. Desde el principio, los cirujanos se pusieron a implantar el Infuse en otras partes de la columna sin la autorización de la FDA. Por ejemplo, lo implantaron para reparar los discos desgastados en las cervicales.
Es legal que los doctores usen un producto para operaciones no autorizadas por la FDA, pero los fabricantes están vetados para promocionar su uso no prescrito en las instrucciones del material sanitario. En su declaración a ICIJ, Medtronic subrayó que la compañía solo pone en el mercado productos para que se utilicen conforme a lo aprobado por los organismos reguladores como la FDA. También negó que hiciera pagos a los doctores para promover o usar sus productos de formas no autorizadas.
Sin embargo, varios de sus empleados alegaron en un litigio contra la compañía que los representantes de ventas y consultores de Medtronic habían sido partícipes de una campaña de promoción para lograr que los cirujanos usaran Infuse en operaciones de columna no autorizadas por la FDA.
Los grandes vendedores ganaron generosas comisiones. “Ellos insistieron en vender más, más y más, comentó en una entrevista Bobbie Vaden, contable del departamento de columna vertebral de Medtronic.
Un amigo de Vaden, ex encargada senior de viajes, Jacqueline Kay Poteet, dijo en un entrevista independiente que su trabajo consistía organizar estancias en hoteles de lujo y allí ganarse su lealtad regalándoles relojes Rolex.
“Yo era amiga de ellos (los médidos) cuando podía conseguirles pasajes en primera clase”, dijo Poteet. “Luego ya no eran más mis amigos”.
Uno de los doctores con los que ella trabajó fue David Polly Jr., exjefe de Ortopedia en el Walter Reed Army Medical Center de Washington. Poteet indicó que reservaba viajes al doctor Polly para hablar en conferencias sobre operaciones de columna vertebral en el Caribe y Europa. Medtronic pagó a Polly unos 600.000 dólares entre 2003 y 2005, según un libro de contabilidad entregado a los investigadores del Senado de Estados Unidos.
Polly, en la actualidad profesor en la Universidad de Minnesota, declinó contestar a las preguntas de los reporteros. Los documentos demuestran que él hizo labores de consultoría e impartió cursos para Medtronic. En declaraciones a ‘The New York Times’, Polly había afirmado que los pagos realizados por Medtronic no habían influido en su praxis profesional.
También usó Infuse para tratar a soldados heridos en las guerras de Afganistán e Iraq, según se recoge en el procedimiento legal abierto por Vaden y Poteet. En 2004, Polly y otros dos médicos publicaron un informe positivo sobre una caja absorbible usada junto al Infuse para cirugías espinales en soldados y otros pacientes. La FDA había aprobado el uso de esas cajas, pero no en la columna vertebral porque no podían soportar cargas pesadas.
Los doctores, aunque puedan usar los dispositivos fuera de lo indicado por la FDA, en este caso no solicitaron permiso para su investigación, según relatan oficiales del ejército.
En 2008, otro cirujano, Timothy Kuklo, publicó un ensayo sobre soldados heridos tratados con Infuse en el hospital Walter Reed. El artículo fue retirado después de que el ejército notificara a la revista médica que Kuklo lo había firmado sin consentimiento. El estudio había exagerado los beneficios de Infuse, según informó ‘The New York Times’ de fuentes del propio ejército. Más tarde, Medtronic reconoció que había retribuido con casi 800.000 dólares al doctor Kuklo por servicios de consultoría entre 2001 y 2009.
Ni Kuklo ni el ejército respondieron a nuestras preguntas. El anterior abogado del doctor, Henry Dane, manifestó que no se habían hallado evidencias claras de que esos estudios fueran fabricados en favor de Medtronic.
Los dos ex empleados, Poteet y Vaden, presentaron una demanda como denunciantes internos, la que fue descartada. Pero su información y documentos sobre Infuse ayudaron a que se realizara una investigación del Senado.
En la primavera de 2008, las autoridades cercaron a Medtronic en diferentes frentes. En mayo, Medtronic aceptó pagar una indemnización de 75 millones de dólares para resolver las acusaciones sobre el mal uso de los tratamientos de columna, con los que habría defraudado a Medicare, el seguro de salud estadounidense para ciudadanos mayores y personas jóvenes con discapacidad. La compañía firmó un convenio de integridad corporativa con validez para cinco años con el inspector general del Departamento de Salud y Servicios Sociales. Mediante ese pacto, Medtronic se comprometía a corregir errores, revisar las relaciones con los doctores y someterse a la legislación vigente. Esa es la promesa remitida por Medtronic a Washington a finales de 2008.
Infuse había sido “usado con éxito” en más de medio millón de pacientes, según anunció Medtronic en la primavera de 2008. Un análisis de mercado interno de la multinacional estimó que Infuse había sido usado fuera de la prescripción autorizada entre un 60% y un 85% de las veces.
En julio de 2008, la FDA lanzó una alerta a los médicos. La agencia sanitaria denunció que se habían registrado 38 informes que hablaban de “complicaciones vitales” por el uso de Infuse en pacientes operados en las cervicales. Los pacientes habían notificado que sufrían inflamación en el cuello y la garganta, lo que les provocaba dificultades para tragar, hablar y respirar. Las complicaciones requirieron traqueotomías en algunos casos.
UNA CADENCIA HORRIBLE Y TRÁGICA
Shirley Nisbet nunca se enteró de la alerta.
El 21 de agosto de 2008, antes del amanecer, su esposo la llevaba al hospital Baldwin Park de California para una operación en el cuello. Nisbet sufría un dolor constante. Su cirujano ortopédico, Johannes Bernbeck, le había dicho que los tejidos de su médula espinal estaban haciendo presión y debían ser extraídos.
Un representante de Medtronic estaba en el quirófano, algo que es común en la industria de los implantes cuando el material puede causar problemas. Durante la operación, este animó al cirujano a tratar las vértebras del cuello de Nisbet con el Infuse, según se lee en el escrito de demanda judicial presentado por su familia.

Shirley Nisbet falleció cuatro días después de su cirugía, en 2008.
Después de la cirugía, Nisbet sufrió todas las complicaciones recogidas en la alerta de la FDA. Su cuello se inflamó y tenía problemas para tragar. Su respiración se hizo costosa. En la mañana del 26 de agosto, la mujer de 74 años, madre de tres hijos, entró en coma. Falleció cuatros días después.
El doctor Bernbeck, que no fue imputado en el proceso judicial, invitó a los periodistas a que realizaran las preguntas al hospital. Los responsables del centro médico declinaron contestar, con la excusa de proteger la privacidad de la paciente. En aquel entonces, Medtronic negó irregularidad alguna y argumentó que su representante nunca recomendó el uso no prescrito del Infuse durante la operación a Nisbet.
La causa judicial fue archivada.
Cuatro años después de la muerte de Nisbet, el Comité Económico del Senado de Estados Unidos publicó un informe inclemente de 2.300 páginas basado en 5.000 folios de archivos internos de la empresa datados entre 1996 y 2011.
El informe acusaba a Medtronic de haber ocultado el pago de 210 millones de dólares a médicos que habían redactado 13 estudios a favor del Infuse. Esos ensayos nunca mencionaron que investigadores independientes habían reconocido graves riesgos por su uso. Entre ellos, que el Infuse podía causar cáncer e infertilidad masculina.
A raíz de la investigación del Senado, la multinacional afirmó que había mejorado sus políticas de ayudas económicas a investigadores e incrementó la transparencia. A comienzos de 2012, Medtronic contrató a James Kirwin, un veterano de la industria, para perfeccionar las pruebas clínicas de los productos en el departamento de columna vertebral. Un año después, Kirwin dijo en una entrevista que uno de los miembros de su equipo había encontrado un artículo en una estantería en la que se informaba de más de mil lesionados y fallecidos por el uso del Infuse. Esos hechos no habían sido comunicados a la FDA.
Kirwin se mostró preocupado sobre el hecho de que Medtronic hubiera vulnerado la legislación al no haber informado de esos incidentes en 2008. Medtronic informó entonces de esos incidentes a las instituciones y atribuyó la demora a un fallo de archivo de los datos. Clark señaló que la compañía se esfuerza en notificar los incidentes tan pronto como suceden.
Kirwin indicó que nunca llegó a comprender por qué los resultados del estudio no fueron comunicados a tiempo: “Jamás he sabido si se hizo por incompetencia o maldad”.
DURGAPUR (INDIA): CORAZÓN SANO PARA TODOS
El pacto ético de 2008 no zanjó los problemas de Medtronic con las autoridades estadounidenses. Dos años más tarde, mientras el Senado se centraba en investigar los pagos de Medtronic a médicos, el director ejecutivo, William Hawkins, anunciaba su jubilación a los 56 años. Lo relevó Omar Ishrak, un ingeniero nacido en Bangladesh que provenía de la unidad de sanidad de General Electric.
Su mandato comenzó anunciando la renovación del compromiso ético de la empresa. La misión de la compañía “nos exige ser insuperables en nuestro buen hacer y ser reconocidos como una empresa que se esfuerza por valores como la dedicación, la honestidad, la integridad y un servicio impecable”, dijo Ishrak.
En su primera teleconferencia con los inversores de Medtronic, Ishrak contó que la compañía se centraría en suministrar mejores y menos caros productos a los pacientes. Añadió que crearía nuevos modelos de negocio e incrementaría las ventas internacionales, muy especialmente en países en desarrollo.
Medtronic se fijó en la India, con un mercado de 1.200 millones de potenciales clientes, como su objetivo principal. En una entrevista concedida en ese momento, Ishrak afirmó que la India como el “agujero más grande” de la multinacional.
Uno de los grandes retos que afrontó la empresa fue rebajar el coste de sus productos. La mayoría de los indios no tenían seguro médico y la renta per cápita promedio era de unos 1.500 dólares.
Al finales de 2010, Medtronic India lanzó el programa ‘Corazón sano para todos”. Su objetivo era vender marcapasos y stents coronarios a pacientes de rentas bajas para reducir el costo de los dispositivos y, además, ofrecer préstamos para que los enfermos pudieran pagarlos.
La compañía encontró unos grandes aliados en los hospitales privados de la India.
El primero fue el Mission Hospital, una instalación nueva de 360 camas en Durgapur, una ciudad dedicada al acero ubicada a unos 160 kilómetros de Calcuta. El hospital pretendía ofrecer cuidados médicos que todo el mundo pudiera costear. Pero su objetivo idealista se topó enseguida con la realidad. “En un principio, nuestro lema era sanidad para todos, pero nada es gratis”, contó el director del hospital, Satyajit Bose, en una entrevista.
Los ejecutivos de Medtronic en la India ofrecieron ayuda al hospital para atraer a nuevos pacientes mediante créditos al consumo y basados en el modelo estadounidense de campañas de márketing. El hospital publicó anuncios en periódicos locales promocionando la salud cardíaca y organizó eventos publicitarios en el centro de Durgapur. Medtronic había contratado a una empresa de consultoría para ayudar al hospital.

El Mission Hospital en Durgapur, India.
La primera paciente fue una madre soltera de esa ciudad. Su sonrisa fue plasmada en carteles publicitarios de Durgapur. Uno de esos carteles decía: “Marcapasos a precios asequibles para quienes no tengan recursos económicos”.
El hospital instaló gratis monitores de análisis de corazón en escuelas y templos rurales. Cientos de pacientes hicieron cola para que les realizaran una diagnosis de sus problemas de corazón. Uno de cada diez fue remitidos al hospital para que se hiciera más análisis. Según el doctor Bose y documentos corporativos de Medtronic, a muchos se les recomendó el implante de un marcapasos, stents coronarios o desfibriladores.
Ya en el hospital, los pacientes podían optar por préstamos que cubrían hasta el 85% del costo del dispositivo a un interés del 8,25%, según se lee en documentos comerciales. Los préstamos eran concedidos por la Fundación Matrika, una organización sin ánimo de lucro ubicada en un apartamento desvencijado del norte de Bombay. Kiran More, uno de los patronos de la fundación, comentó a ICIJ que Medtronic proveía fondos para los préstamos. La empresa no respondió a las preguntas sobre el rol de la fundación, pero dijo que el programa incluía asistencia financiera a pacientes que de otra forma habían sido forzado a usar “prestamista informales para financiar el procedimiento a una tasa extremadamente alta”.
A finales de 2012, la campaña había evaluado a 20.000 pacientes y a 2.000 de ellos se les había implantado un dispositivo cardíaco, según Medtronic. Un año después, los hospitales de hasta 20 ciudades tenían un programa similar. Inicialmente sólo eran cuatro.
En aquel entonces, el doctor Sanjay Tarlekar, director del hospital Shushrusha, asociado con Medtronic y situado en un suburbio de Bombay, elogiaba el programa ‘Corazón sano para todos’ describiéndolo como un “alivio tanto para pacientes como hospitales”.
Algunos médicos comenzaron a inquietarse por ese programa, ya que la deuda que estaban asumiendo los pobres era enorme para ellos. También se mostraron preocupados por el hecho de que la financiación de productos sanitarios pudiera animar a los doctores a recomendar cirugías a pacientes que realmente no las necesitaban.
“Incitar a la gente pobre para que se endeude no es muy razonable”, señaló el doctor Ajit Mullasari, director de Cardiología del hospital Madras Medical Mission.
En 2014, un grupo defensores de consumidores comenzó a cuestionar las prácticas de Medtronic en India. El grupo presentó una denuncia ante las autoridades sanitarias del estado de Maharashtra. El grupo basado en Bombay acusó a la filial de Medtronic en la India y a seis empresas distribuidoras de vender productos a “precios exorbitantes” y pagar a sobornos a doctores.
Aunque las instituciones no hallaron ninguna evidencia de corrupción, su informe subrayó que los pacientes habían pagado precios “exagerados” por stents de Medtronic. Habían pagado un precio 12 veces superior al valor de importación del producto. Las autoridades también comunicaron que Medtronic India estaba obteniendo “beneficios enormes” a costa de “víctimas pobres”, los pacientes.
Tanto el Mission Hospital de Durgapur como el Shushrusha Heart Care de Bombay tuvieron más cuidado a la hora de aplicar el programa ‘Corazón sano para todos’, según refirieron sus directores. Otros cuatro hospitales identificados por aplicar ese programa desestimaron contestar a las cuestiones planteadas por ICIJ. Medtronic explicó que terminó con el programa el año pasado “debido a las dinámicas cambiantes del sector sanitario y a su baja visibilidad”.
Hoy día, Sanjay Tarlekar, director del hospital Shushrusha Heart Care, afirma que Medtronic no cumplió su promesa de tratar los pacientes necesitados con dispositivos baratos: “Nos engañaron”.
VENTAS Y SEGURIDAD
La mayor apuesta de Medtronic para crecer ha sido su unidad para combatir y aliviar la diabetes, situada en Northridge (California). Ese departamento fabrica monitores de glucosa, sensores y bombas de insulina. La inyección de dosis controladas de insulina elimina la necesidad de estar pinchándose constantemente en la yema de los dedos para medir la cantidad de glucosa y las molestas inyecciones diarias.
El mercado mundial de diabetes, tanto de fabricantes de medicinas como de dispositivos, es enorme. Los estados gastaron 1,3 mil millones de dólares en tratamientos para la diabetes en 2015. Los gastos se están incrementando. Una bomba de insulina puede llegar a costar 6.000 dólares anuales y los cargas de insulina entre 3.000 y 6.000 dólares. Los pacientes que cambian de las inyecciones diarias de insulina a las bombas pueden reducir la factura en unos 650 dólares al año.
Medtronic domina desde hace tiempo el mercado de las bombas de insulina para el tratamiento de la diabetes tipo 1, la más grave. Se suele desarrollar en niños y jóvenes adultos y representa entre el 5% y el 10% del total de los casos de diabetes.
En los últimos años, los competidores han comenzado a comercializar innovadores dispositivos para combatir la diabetes, erosionando la ventaja tecnológica de Medtronic. La presión ha crecido dentro del departamento de Northridge para vender más, sostuvieron empleados involucrados en litigios judiciales.
Según una demanda interpuesta por Adam Witkin, un exjefe comercial de Oregon, la compañía se planteó ampliar su base de clientes con la diabetes tipo 2, que se asocia a la obesidad y a la vejez. El fallo está pendiente.
Witkin indicó que la empresa incentivaba a los médicos a promover el uso de las bombas de insulina y otros dispositivos de Medtronic con charlas, servicios gratis, financiamiento de investigaciones, viajes y lujosas cenas.
Un memo de Medtronic, adjunto como prueba en la causa judicial, animaba a los representantes a desarrollar relaciones con los empleados de la oficina del doctor y describía cuán fácil era acceder a información confidencial de los pacientes en una clínica de un endocrinólogo en Las Vegas. “Deberías sentirte a tus anchas en su oficina con el fin de conseguir gráficos”, se leía en la memoria. “En una ocasión estuve revisando todos los documentos relativos a los pacientes y pude subrayar los potenciales clientes de bombas de insulina. Hay que hacerlo de nuevo”, señalaba el autor del escrito.
Con el fin de dirigir la venta de esas bombas, Witkin atestiguó en el litigio que él y otros vendedores de Medtronic a veces insertaban en los pacientes sensores de monitorización, un procedimiento médico para el cual algunos representantes no estaban autorizados.
“Desconozco la legislación o la certificación oportuna como para realizar ningún diagnóstico”, escribió Witkin en una carta al departamento legal de Medtronic en febrero de 2011.
Witkin afirmó que fue despedido por quejarse ante la FDA y ante otros por las prácticas de la compañía. Medtronic disputó sus acusaciones y aseguró en sede judicial que Witkins fue despedido por su comportamiento. Lla división de diabetes salvaguardaba los estándares éticos más altos, afirmó la empresa. La compañía argumentó que tanto Witkin como los demás empleados habían recibido formación para no sobornar y que fueron informados puntualmente de que sólo los médicos o los profesionales autorizados podían llevar a cabo procedimientos sanitarios. Añadía la empresa que a los médicos sólo se les permitía cobrar por los servicios que proveían.
En una demanda independiente, otro trabajador del departamento de diabetes, David Zuzick, alertó en cuatro ocasiones a los supervisores sobre que el nuevo dispositivo de control de la glucosa, Sentrion, aún no estaba listo para su utilización en pacientes. Ocurrió entre 2009 y 2013. O al menos todavía no estaba preparado sin que “se avisara claramente” a sus usuarios de los riesgos potenciales por su aplicación. El aparato había sido comercializado en Europa sin que se hubieran llevado a cabo los adecuados exámenes de seguridad, según una demanda autoinculpatoria que Zuzick presentó en la corte federal de California.
Zuzick, exdirector de planificación de producto, también señaló en la demanda que los jefes de Medtronic le dijeron que no tuviera en cuenta los datos clínicos que “no defendieran la seguridad y el buen funcionamiento de Sentrino”.
Medtronic negó todas esas acusaciones de Zuzick ante los tribunales antes de alcanzar un acuerdo extrajudicial con él en 2017. En declaraciones al ICIJ, la empresa rechazó en todo momento que hubiera suprimido datos clínicos sobre producto alguno.
Durante el pleito, sus inquietudes sobre la calidad y los problemas de desarrollo del producto fueron ratificadas por la FDA en septiembre de 2013 cuando esta autoridad mandó una carta de aviso a Medtronic. Citó errores similares a los denunciados por Zuzick durante casi dos años.
Las ventas de los productos de Medtronic para combatir la diabetes incrementaron sus ventas en la medida que países como Alemania, Australia o Chile autorizaban subvenciones o seguros de cobertura para adquirir las bombas de insulina. En Estados Unidos, Medtronic alcanzó acuerdos para vender sus bombas con la aseguradora UnitedHealthcare y el Departamento de los Veteranos de Guerra.
Durante el decenio 2008-2017, las bombas de insulina de Medtronic provocaron 20 retiradas del mercado y se interpusieron cerca de 100 causas judiciales por su mal funcionamiento.
En una carta firmada en 2013, la FDA amonestó a la firma por no investigar o responder a tiempo a las reclamaciones de los consumidores o incluso a las muertes de pacientes. En uno de los casos, según la FDA, el aviso tardío sobre el posible mal funcionamiento de una bomba podría haber provocado una sobredosis de insulina, lo que a un paciente le originó un coma diabético.
La carta de advertencia también notificaba que las bombas de insulina estaban violando las normas estadounidenses sobre la calidad de los productos, tales como fugas de insulina, problemas de fabricación, cambios de diseño sin testar, fallos del software o formación inadecuada de los empleados.
El análisis de ICIJ y Associated Press de la base de datos de la FDA revela que entre 2008 y 2017 las bombas de insulina y sus componente registran el número más alto de eventos adversos reportados al regulador en EE.UU. Desde 2008, las bombas de insulina de Medronic y sus componentes están potencialmente relacionadas con 2.600 muertes y 150.000 lesiones a pacientes
Medtronic explicó que esos incidentes adversos comunicados a la FDA sobre fallecimientos y lesiones pueden ser engañosos o estar basados en informaciones incompletas o poco fiables, de modo que es imposible extraer conclusiones sobre si esos aparatos médicos son defectuosos. Según la empresa, sus bombas de insulina han ayudado a cientos de miles de pacientes a aliviar su diabetes y arguye que la retirada de un dispositivo no significa que sea defectuoso o peligroso. Su portavoz, Rob Clark, asegura que Medtronic siempre comunica a los doctores y los pacientes en tiempo y forma cuando una retirada del aparato resulta necesaria.
En entrevistas con los medios de la investigación “The Implant Files”, familias de Finlandia, Alemania, Canadá, India y Estados Unidos manifestaron que Medtronic actuó con lentitud a la hora de responder a sus reclamos sobre las bombas de insulina y falló en informarles oportunamente sobre sus riesgos.
En agosto de 2017, en Alahärmä, ciudad occidental de Finlandia, Roope Kauppi, de tan sólo 12 años, se levantó en medio de la noche con niveles peligrosos de azúcar en sangre. Gritó para pedir auxilio. Mientras esperaban una ambulancia, el niño se mareó en los brazos de su padre y perdió la conciencia. El chico se recuperó, pero sus padres sospecharon que la bomba había inyectado más insulina de la debida.
En entrevista con el socio local de ICIJ, Yle, la familia Kauppi relató que habían enviado la bomba de insulina a Medtronic para que la revisaran. Aún esperan los resultados. “Está bien cuando el aparato funciona, pero puede ser peligroso cuando no lo hace, ya que puede ocurrir cualquier cosa”, explicó el padre del niño.
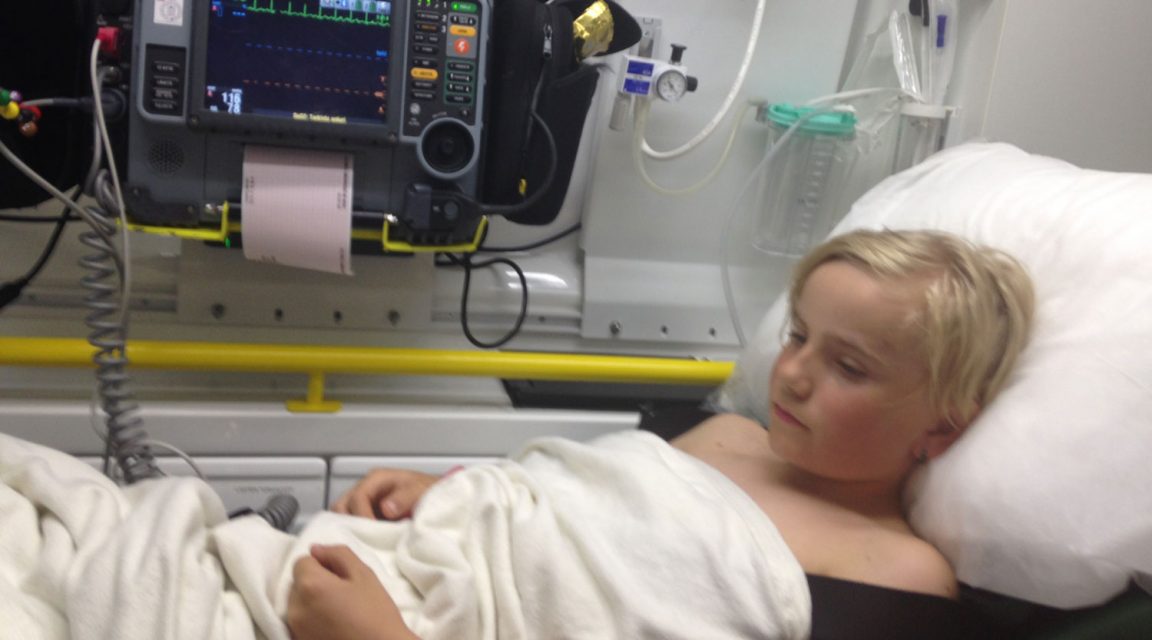
Roope Kauppi fue llevado al hospital en medio de la noche por problemas en su bomba de insulina.
UNA MÁQUINA DE HACER ‘LOBBY’
En junio de 2014, durante una conferencia organizada por Goldman Sachs en Rancho Palos Verdes (California), una muchedumbre de inversores y gente de la industria esperaba para escuchar a Omar Ishrak, director ejecutivo de Medtronic. Querían conocer la nueva gama de productos y qué innovaciones habría.
Una persona entre el público preguntó: “Enséñame el dinero”. El dinero que iban a ganar los accionistas con las innovaciones.
Menos de una semana después, Medtronic anunció uno de los más grandes acuerdos en la historia de los productos sanitarios tecnológicos: la adquisición de su competidor Covidien PLC, radicado en Irlanda, a cambio de 43.000 millones de dólares. Ese movimiento societario implicaba que Medtronic mantendría su sede en Minneapolis, pero estaría registrada en un único piso de un modesto edificio de Dublín. La maniobra significaba que Medtronic pagaría sus impuestos de 12,5% en lugar del 35% que pagaba en los Estados Unidos. También podía tener 14.000 millones de dólares en el extranjero sin pasar por la caja tributaria estadounidense.
Wall Street aplaudió. Sin embargo ese tipo de triquiñuelas, algo habitual entre las multinacionales estadounidenses, estaban provocando un terremoto político. El entonces presidente Barack Obama calificó esos arreglos, conocidos como inversiones tributarias, como una forma de “timo al sistema” y su partido propuso un proyecto de ley para imponer una moratoria a esos movimientos societarios.
Por ese entonces, Medtronic ya contaba con extraordinarios equipos legales y de ‘lobby’. Una de sus grandes victorias incluye haber ganado un caso en el Tribunal Supremo de Estados Unidos que sentó jurisprudencia. Esto redujo grandemente la posibilidad de que los pacientes puedan poner demandas por productos sanitarios defectuosos. En el momento en que cuatro congresistas intentaron legislar para que se restaurase la opción de los pacientes por litigar, Medtronic y otras compañías del sector hicieron presión para finiquitar esa iniciativa. La firma gastó cerca de 2 millones de dólares para influir en el poder regulador de la FDA y hacer más fácil la venta de productos que no están testados médicamente para no dañar a niños y adultos.
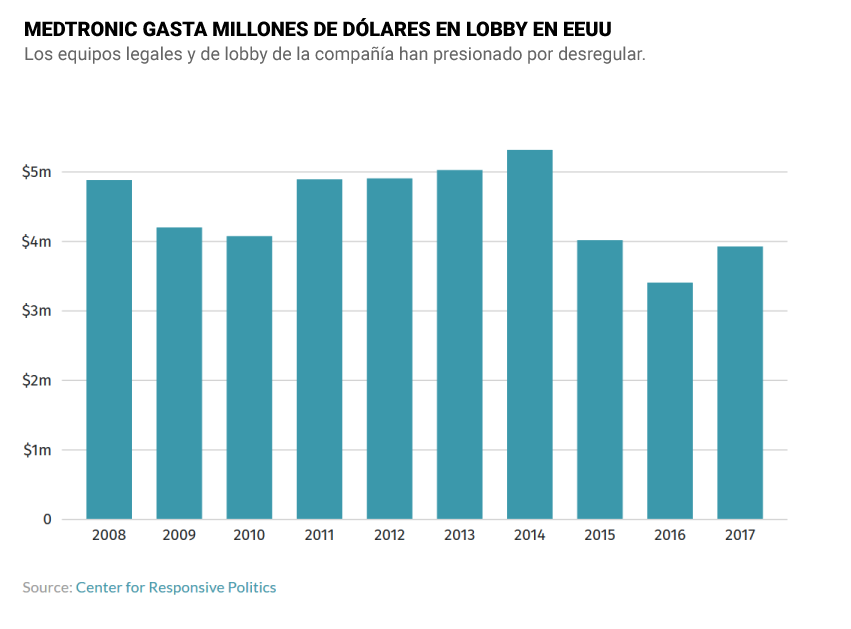
Después del escándalo de su traslado a Irlanda por razones tributarias, Medtronic contrató al bufete de abogados de los senadores Tren Lott, líder de la mayoría de los republicanos en el Senado, y de John Breaux, un demócrata de Luisiana. Les pagó 200.000 dólares, tan sólo el 4% del total de 5,3 millones de dólares que gastó en 2014 para hacer ‘lobby’. Nunca jamás había gastado tanto en hacer presión. Lo hizo para ejercer oposición al proyecto de moratoria sobre inversiones en otros países para ahorrar en impuestos. El proyecto ley, al que se oponían numerosas firmas de Estados Unidos, murió en un comité. Medtronic tenía el camino despejado.
El portavoz de Medtronic señaló que las prácticas de ‘lobby’ se acomodan a la misión de la compañía para salvar la vida de enfermos. Para conseguir ese objetivo, según Rob Clark, Medtronic “debe mantener un diálogo fluido con los funcionarios que tienen capacidad de influencia en el diseño de la política sanitaria”.
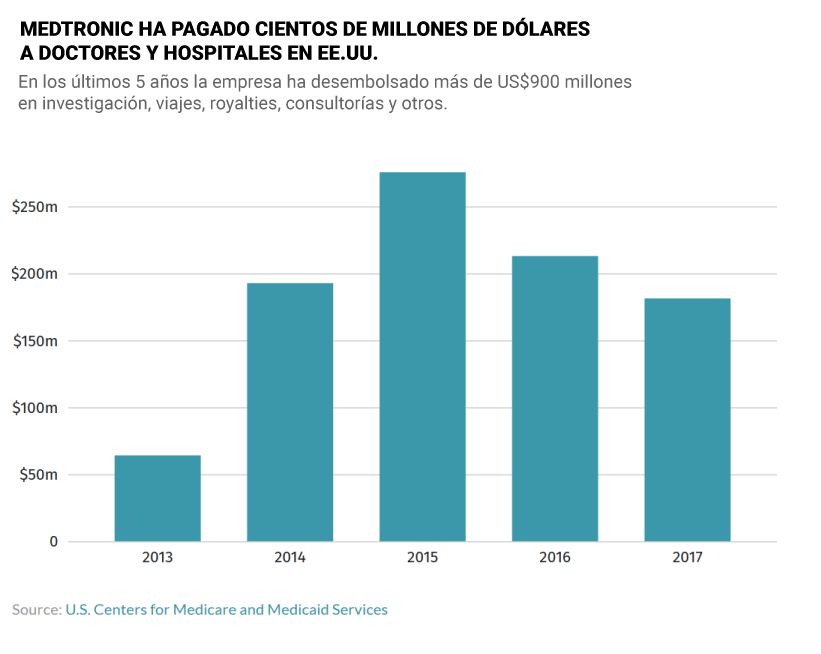
Por otro lado, entre 2014 y 2017, Medtronic pagó 862 millones de dólares a médicos e instituciones de investigación científica para realizar estudios, formación y trabajos de consultoría, según datos obtenidos de centros de asistencia sanitaria a ancianos y a personas necesitadas de Estados Unidos. Esos datos evidencian que el neurocirujano Keven Foley, director de un laboratorio de investigación y formación en Memphis, recibió 74 millones de dólares de Medtronic por sus patentes, investigación y labor de consultoría.
En ese mismo periodo, Medtronic donó millones de dólares para que grupos defensores del libre comercio y de los pacientes promocionaran sus productos. Entre esas donaciones, otorgó cinco millones a la Cardiovascular Research Foundation. Se trata de un grupo de investigación sin ánimo de lucro que colocó el logo de Medtronic en sus programas y casetas, además de que la multinacional financiara debates multitudinarios en la sede de esa fundación.
LA VAGUEDAD DE SU COMPROMISO ÉTICO
Mientras Medtronic se internacionalizaba, continuaba haciendo frente a multitud de acusaciones por la violación de su compromiso con las leyes vigentes.
A comienzos de 2015, la compañía se vio obligada a pagar 7,2 millones de dólares para llegar a un acuerdo con el Departamento de Justicia tras afrontar dos casos en los tribunales comenzados tras la delación de un par de informantes. Uno de ellos inculpó a Medtronic por haber pagado sobornos a médicos con el fin de que usaran estimuladores medulares en operaciones no autorizadas. El otro delator acusó a la firma de haber importado de China aparatos para el tratamiento de la columna y después los había reetiquetado como “fabricados en Memphis”. En ninguno de los casos, Medtronic admitió las imputaciones.
La compañía también tuvo que responder a una alerta de seguridad de uno de sus productos estrella, la bomba de infusión implantable Synchromed II, que combate el dolor crónico. En abril de 2015, después de 22 retiradas del mercado de ese producto desde 2004 y los hallazgos de que Medtronic habría fallado en corregir los defectos del aparato, el director ejecutivo firmó un pacto de 27 páginas por el que se comprometía con el Departamento de Justicia a interrumpir drásticamente la venta de esas bombas de inyección de medicamentos. Las complicaciones del dispositivo consistían en que, por exceso o por defecto, aplicaban una dosis errónea de medicamento, causando graves problemas a los pacientes.
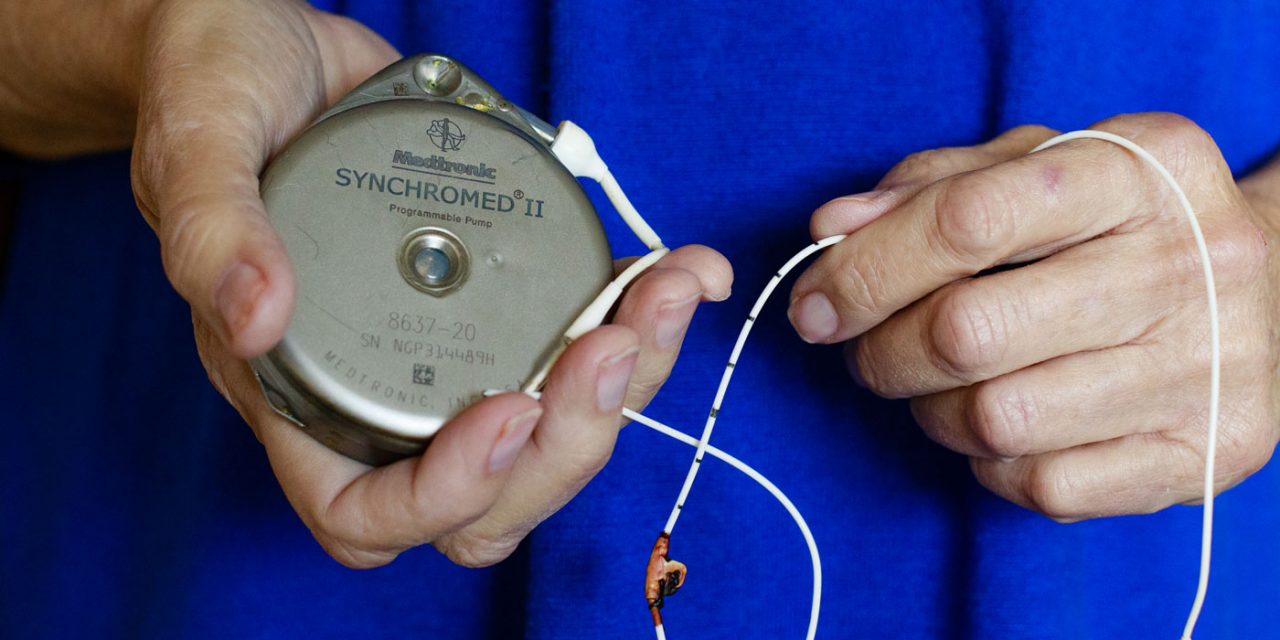
La bomba Synchromed II, de Medtronic
Una inspección de la FDA un año después descubrió que Medtronic aún no había solucionado los defectos.
En la década 2008-2017, esas bombas para combatir el dolor crónico originaron 800 muertes y 35.000 lesiones de diferente gravedad a los pacientes, según los incidentes adversos registrados en la base de datos de la FDA.
Medtronic explicó que había colaborado con la FDA para corregir los problemas. Según su portavoz, ahora la compañía está fabricando y comercializando un sistema seguro de SynchroMed.
En noviembre de ese año, la filial brasileña de Medtronic ofreció información a la comisión de la competencia de Brasil sobre cómo Medtronic y otros tres rivales habían participado durante todo un decenio en un esquema de fijación de precios en las licitaciones. Medtronic habría reconocido que las compañías habrían conspirado para inflar el precio de los dispositivos cardíacos. En un pacto secreto de las cuatro empresas se habrían repartido el mercado expulsando a sus rivales de los contratos licitados.
La investigación no está cerrada aún. Medtronic declinó hacer comentario alguno sobre la misma. En un informe de 119 páginas, el Consejo Administrativo de Defensa Económica brasileño señaló que Medtronic “había confesado” una “supuesto complot” como parte de un acuerdo para reducir la sanción.
En noviembre de 2016, los reguladores de China multaron a la filial de Medtronic en Shanghai con 17 millones de dólares por fijar precios. Descubrieron que entre 2014 y 2016 la multinacional había impuesto un mínimo precio de venta a los distribuidores y minoristas. Ese tipo de prácticas, en relación a los convenios alcanzados con las autoridades chinas, coartan la libre competencia y perjudican a los pacientes al mantener los precios altos.
ADUEÑÁNDOSE DE LA ENFERMEDAD
A finales de 2016, Omar Ishrak estaban planificando el nuevo curso de su compañía. Medtronic ya no vendía solamente productos sanitarios. Había comenzado a gestionar los laboratorios de pruebas cardíacas en hospitales y de las clínicas dedicadas a combatir la diabetes, supervisaba su equipamiento y el suministro de esos centros médicos, ayudaba a administrar los gastos derivados de reembolsos, proporcionaba servicios de consultoría y mucho más.
En resumen, Medtronic estaba transformándose en lo que llamaba “ventanilla única” para la comunidad médica, una empresa en plena expansión al contrario que sus competidores. Como un analista entusiasta de PricewaterhouseCoopers señaló, en el tratamiento de dolencias cardíacas y de la diabetes, Medtronic “se adueñaría de la enfermedad”.
El director ejecutivo se pasó todo un año viajando a eventos de la industria por todo el mundo viéndose con funcionarios y pintando una cuadro desolador de los sistemas de salud mundiales por ineficientes, caros y con una urgente necesidad de reorganización.
En un discurso ofrecido en Cleveland ese otoño, Ishrak aseguró que la industria de los productos sanitarios y todos los sistemas de salud tenían que cambiar. “Hemos visto que el coste de los sistemas de salud se incrementan. Pero el sistema adolece de gran ineficiencia y pensamos, al contrario de como se dice, que los cimientos de la capacidad de innovación comienzan a fallar”, argumentó.
Cortejando a los inversores, los ejecutivos de Medtronic explicaron que el modelo sanitario integral que planteaba, como único proveedor de una amplia gama de productos y servicios, ayudaría a los hospitales a reducir sus costos y a ofrecer una mejor atención. También garantizaría buenos precios para los dispositivos y transformaría Medtronic en un gigante de la asistencia sanitaria.
Los agentes de Medtronic se lanzaron a ejercer ‘lobby’ sobre los funcionarios y los gerentes de los hospitales, formulando un amplio abanico de propuestas para atraer pacientes, mejorar la asistencia e incrementar los ingresos por la gestión de los quirófanos. Los relojes Rolex y las cenas lujosas se cambiaron por otro tipo de incentivos persuadir a sus potenciales clientes: productos implantables, equipamiento médico y empleados serían suministrados gratis tras firmar contratos con los hospitales. Como resultado, Medtronic recibiría un porcentaje de los ingresos crecientes de los hospitales generados por una gestión más eficiente.
En 2017 in Toulouse, Francia, un renombrado centro cardíaco, la Clínica Pasteur, suscribió un acuerdo. Según documentos confidenciales obtenidos por el socio local de ICIJ, Radio France, Medtronic proveería al hospital un quirófano de punta y servicios como consultoría en la gestión de pacientes y ayudaría a conseguir pacientes en otros países. A cambio, el hospital pagaría a Medtronic un montó por cada procedimiento médico completado, de acuerdo a Radio France. Si el hospital vendía más de 5 millones de dólares en válvulas cardíacas, recibiría válvulas gratis o con descuento.
Medtronic, dice el documento, esperaba convertirse en la principal fuente de válvulas cardíacas del hospital y generar 21 millones de dólares en ventas por eso servicios en tres años. En su respuesta a Radio France, la Clínica Pasteur confirmó el volumen de válvulas que compró a Medtronic pero declinó comentar el valor comercial del contrato, argumentando confidencialidad.
Ishrak defiende que en este tipo de pactos todos ganan. Algunos administradores de hospitales han alabado a Medtronic por crear una asistencia sanitaria de vanguardia al mismo tiempo que reducen costes y ahorran dinero.
Uno de los primeros acuerdos fue sellado por Medtronic en 2013 con el Imperial College Healthcare NHS Trust de Londres, que pasaba apuros económicos. “Compraríamos algunos (productos de Medtronic) a un precio negociado, y mientras mayor el volumen de dispositivos que compráramos, más bajaría el precio”, afirmó al British Medical Journal, socia de ICIJ en el Reino Unido, el doctor Kevin Fox, un cardiólogo que ayudó a sellar el acuerdo. “Usamos una cantidad importante de equipamiento de Medtronic, pero exclusivamente”, dijo Fox.
A cinco años de los siete que considera el contrato, no hay realmente una forma de medir si el acuerdo ha mejorado la calidad de la atención o si el hospital de Londres ha ahorrado dinero, señaló Fox. También dijo que ha recibido dinero de Medtronic por dar conferencias, pero declinó decir cuánto dinero le ha pagado la empresa.
Algunos expertos apuntaron que esos acuerdos crearon conflictos de interés mediante la fidelización de profesionales médicos y unos mejores precios para que los ingresos de los hospitales crecieran. Como consecuencia directa, esos profesionales podían animar al uso y abuso de productos electrónicos de Medtronic, incluso cuando otras marcas podían ser mejor para el paciente.
“Esa motivación económica por el beneficio transformará los sistemas sanitarios en la gallina de los huevos de oro más que en servicios profesionales al servicio de los pacientes”, manifestó el doctor Nortin Hadler, profesor emérito de Medicina en la Universidad de Carolina del Norte en Chapel Hill. “Puedo vislumbrar un eslogan de marketing para mi hospital: ‘Lo que es bueno para Medtronic es bueno para el paciente’”, comentó este autor de siete libros sobre la política sanitaria.
Antiguos profesionales sanitarios alegan que pactos similares han creado incentivos para los médicos siempre que usen dispositivos cardíacos y bombas de insulina de Medtronic.
En una causa judicial motivada por la declaración de un delator abierta en la corte federal de Pensilvania, Cathleen Forney, una antigua jefa de demarcación de Medtronic en ese estado, explicó que la empresa “remuneraba en forma de millones de dólares a quienes tomaran las decisiones de compras de productos Medtronic”.
Su demanda proporcionaba el nombre de doctores en 21 estados diferentes quienes, según ella, habrían facturado ilegalmente al sistema de asistencia sanitaria a ancianos por operaciones llevadas a cabo por empleados de Medtronic, que incluían la revisión y la programación de dispositivos de pacientes. El esquema era una forma de soborno, Forney afirmó, porque evitaba que los médicos contrataran a sus propios empleados.
Medtronic solicitó en un documento presentado ante el juzgado que la demanda de Forney debía ser desestimada porque ofrecer asistencia a los médicos y hospitales para que funcionaran sus aparatos correctamente no constituye un soborno ilegal.
En su respuesta al ICIJ, la empresa negó que su nuevo modelo de negocio tuviera la intención de promover sobreprescripción de sus productos o su uso más allá de lo estrictamente autorizado. Afirmó que trabaja codo con codo con los reguladores y legisladores para desarrollar “un marco responsable y ético” en sus colaboraciones.
Hasta la fecha, Medtronic ha firmado cerca de 120 convenios por valor de 2.600 millones de dólares con hospitales de Europa, Canadá, América Latina, Oriente Medio, África y Estados Unidos. Entre sus clientes están hospitales universitarios de Cleveland, Lehigh Valley Health Network de Pensilvania, el Imperial College Healthcare NHS Trust de Londres, o Gbagada Cardiac and Renal Centre de Lagos.
En Italia, algunos médicos y rivales de Medtronic se han quejado a los legisladores de que el nuevo modelo de la multinacional viola las leyes de libre competencia y favorecen las compras de dispositivos electrónicos sanitarios de esa empresa. Argumentan que la filial italiana de Medtronic, NGC Medical S.p.A., sólo suministra productos a material cardíaco a los laboratorios que controla.
A comienzos de 2017, el senador italiano Luigi Gaetti, patólogo de Mantua, y otros legisladores definieron el comportamiento de Medtronic como “contrario a la libre competencia” y solicitaron a los ministros del gobierno que revisaran sus alegaciones. La institución antimonopolio de Italia está en estos momentos examinando el asunto, según los documentos a los que han tenido acceso el programa televisivo ‘Report’ y ICIJ.
ICIJ y sus medios asociados de Suiza, Italia, Reino Unido, México, Canadá y Estados Unidos pidieron información sobre los acuerdos de Medtronic con ciertos hospitales. Los centros declinaron responder o entregaron información muy limitada. El Hospital Universitario de Lausana (Suiza), el New Brunswick Heart Centre y el University Hospitals Cleveland Medical Center aludieron a cláusulas de confidencialidad para negar la información requerida por los periodistas.
El portavoz de Lehigh Valley, Brian Downs, señaló que el acuerdo era demasiado nuevo como para compartir detalles del mismo, pero afirmó que los empleados de Medtronic no estaban ejerciendo ningún tipo de operación médica en su centro hospitalario.
Medtronic también desestimó dar detalles de los contratos a los reporteros. Su portavoz negó que esos convenios violaran las normas de la libre competencia y perjudicaran a los pacientes: “No controlamos o dirigimos las decisiones de los profesionales sanitarios cuando afectan a los cuidados de los pacientes, las prescripciones médicas, el uso de tecnología para tratar a los enfermos o la selección de ciertos productos”.
LOS PACIENTES ‘VERSUS’ GOLIAT
En un caluroso día de la primavera de 2017, un sobre voluminoso llegó a la casa de Joe Gartrell en Orlando (Florida). Le dijo a su esposa Mildred: “Debe ser eso”.
Abrieron el envío en su dormitorio. “Eso” era una pormenorizada declaración que explicaba su indemnización, con algunas deducciones, tras haber llegado a un acuerdo con Medtronic por una operación con el Infuse con el fin objetivo de corregir una dolencia degenerativa de discos.
El corazón de Gartrell se estremeció. Su mujer lo miraba con cara de desconcierto, “como cuando un ciervo es deslumbrado en la carretera por los faros de un coche”, según dijo ella durante una entrevista. No era exactamente lo que estaban esperando.
Medtronic se había decidido finalmente a dar solución a las querellas que afrontaba por el uso de sus productos en operaciones no autorizadas. En la década en la que la FDA la había alertado sobre ese estimulador de crecimiento llamado Infuse, los archivos de esa institución revelan que ese dispositivo está directamente relacionado con el fallecimiento de 20 pacientes y más de 10.000 lesiones de diferente gravedad.
El pasado año, Medtronic llegó a un acuerdo confidencial con la aseguradora estadounidense Humana. Esta había presentado demanda civil que acusaba a la multinacional de organización criminal para sesgar a su favor la redacción de estudios sobre el Infuse. Medtronic también puso final a causas judiciales planteadas por cinco fiscales de EEUU mediante un pacto cerrado en 12 millones de dólares. Además, en julio pasado, tuvo que pagar 43 millones en otro acuerdo extrajudicial para zanjar una demanda interpuesta por algunos de sus accionistas por haber manipulado los artículos sobre el Infuse, lo que había inflado artificialmente el precio de las acciones.
Medtronic niega cualquier mala practica. En su declaración a ICIJ, señala que continúa buscando nuevos usos para el Infuse. Defiende que es seguro, sujeto a investigaciones rigurosas y una alternativa válida para los pacientes que requieran ciertos tipos de operaciones de columna y de trauma.
Después de que sufriera un accidente y el conductor se diera a la fuga en mayo de 2009, al guionista de Hollywood Jerome Lew le implantaron Infuse en su cuello, un tratamiento sin autorización, junto con una caja no aprobada para su uso en esa parte del cuerpo. La operación la realizó un doctor de la Universidad de California de Los Ángeles (UCLA). El médico tiene vínculos económicos con Medtronic. Como resultado, el guionista sufre dolor en los nervios, dificultades para tragar y problemas en brazos y piernas. “Me han quitado poder coger a mis hijos en brazos en sus primeros años y poder ayudarles a dar sus primeros pasos”, indica Lew. Ahora tiene 55 años. Consiguió una indemnización de 4,2 millones de dólares pagada por la UCLA y Medtronic.
La familia de la niña de seis meses Hailey Starr Reuter recibió 650.000 dólares tras llegar a un acuerdo con un centro pediátrico de Cincinati tras una operación. Le colocaron el Infuse en una intervención de cráneo. Este implante no está autorizado en niños sin el consentimiento de sus padres. El Infuse causó que el cráneo de la bebé dejara de crecer porque provocó una fusión prematura de una parte del mismo, según informó su familia. Esto conllevó que tuvieran que realizarle otras tres operaciones de cráneo y cara.
“Las cicactrices de la niña van de oreja a oreja”, contó su madre Tricia.
Joe Gartrell, de 55 años, el que fuera ejecutivo de cuentas de PepsiCo y que había recibido en casa el sobre que incluía un acuerdo con Medtronic, ahora camina con bastón. Siente insensibilidad en sus piernas y ya no podrá volver a bucear y pescar con arpón.
La sensación que guarda Gartrell es que fue usado como “conejillo de indias” en un quirófano en mayo de 2006. Aunque algo aliviará la pena, ninguna suma de dinero podrá compensarlo por lo que le sucedió.
El año pasado, Medtronic reportó que había llegado a acuerdos para cerrar la mayoría de las 6.000 acusaciones por daño relacionadas con Infuse.
Joe Gartrell miró fijamente al acuerdo final: 105.000 dólares. Después leyó lo relativo a las deducciones.
Todo lo que deseaba era un cheque con una suma lo suficientemente alta como para abordar sus facturas médicas. Esto y una disculpa, señaló Gartrell.
Se quedó sin un dólar tras pagar las costas judiciales, afrontar algunos gastos y saldar el préstamo que solicitó para presentar la demanda.
La disculpa jamás llegó.
Han contribuido a la elaboración de este reportaje: Cat Ferguson, Emilia Diaz-Struck, Rigoberto Carvajal, Petra Blum, Christian Baars, Paolo Biondani, Laetitia Cherel, Allan de Abreu, Minna Knus-Galan, Caroline Kubzansky, Jeanne Lenzer, Boyoung Lim, Jesse McLean, Marie Parvex, Kaunain Sheriff, Colm Keena, Giulio Valesini, Christoph Giesen, Holbrook Mohr and Elena Kuch.
Traducción al español: Marcos García Rey.